Năng lượng của các electron trong nguyên tử
Cập nhật lúc: 17:15 14-07-2015 Mục tin: Hóa học lớp 10
Trong nguyên tử, các electron chiếm các obitan theo tứ tự tăng dần mức năng lượng. Sự phân bố electron trong nguyên tử tuân theo nguyên lí Pau-li, nguyên lí vững bền và quy tắc Hun
Năng lượng của các electron trong nguyên tử
I. Kiến thức cần nắm vững:
1. Năng lượng của electron trong nguyên tử:
- Trong nguyên tử, các electron nằm trên mỗi obitan có một mức năng lượng xác định, được gọi là mức năng lượng obitan nguyên tử ( mức năng lượng AO).
- Các electron trên các obitan khác nhau của cùng một phân lớp có năng lượng như nhau.
Ví dụ: Phân lớp 2p có 3 AO: 2px, 2py, 2pz. Các electron của các obitan p này tuy có sự định hướng trong không gian khác nhau, nhưng chúng có cùng mức năng lượng AO.
- Trật tự các mức năng lượng obitan nguyên tử: Khi số hiệu nguyên tử Z tăng, các mức năng lượng AO tăng dần theo trình tự sau:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d…
- Khi điện tích hạt nhân tăng, có sự chèn mức năng lượng: mức 4s trở nên thấp hơn 3d, mức 5s thấp hơp 4d, 6d thấp hơn 4f, 5d…
2. Các nguyên lí và quy tắc phân bố electron trong nguyên tử:
a. Nguyên lí Pau-li:
- Ô lượng tử: Để biểu diễn obitan nguyên tử một cách đơn giản, người ta dùng các ô vuông nhỏ, được gọi là các ô lượng tử. Một ô lượng tử ứng với 1 AO.
VD: n = 1: chỉ có 1 AO-1s => biểu diễn bằng 1 ô vuông
n = 2: có 1 AO-2s và 3 AO-2p => AO 2s được biểu diễn bằng 1 ô vuông ![]() , 3 AO-2p được biểu diễn bằng 3 ô vuông vẽ liền nhau
, 3 AO-2p được biểu diễn bằng 3 ô vuông vẽ liền nhau ![]()
- Nguyên lí Pauli: Trên 1 obitan chỉ có thể có nhiều nhất là 2electron và 2 electron này chuyển động tự quay khác chiều nhau xung quanh trục riêng của mỗi electron.
- Chiều tự quay khác nhau của 2 electron được biểu diễn bằng 2 mũi tên nhỏ: 1 mũi tên có chiều đi lên, 1 mũi tên có chiều đi xuống.
+ Khi trong 1 obitan đã có 2 electron, gọi là các electron ghép đôi:![]() .
.
+ Khi obitan chỉ chứa 1 electron thì electron đó gọi là electron độc thân ![]()
- Số electron tối đa trong 1 lớp và 1 phân lớp:
+ Số electron tối đa trong 1 lớp: 2n2
+ Số electron tối đa trong 1 phân lớp:
|
Phân lớp |
Số AO |
Số electron tối đa |
Trạng thái electron tối đa ở lớp thứ n |
|
s |
1 |
2 |
ns2 |
|
p |
3 |
6 |
np6 |
|
d |
5 |
10 |
nd10 |
|
f |
7 |
14 |
nf14 |
+ Các phân lớp s2, p6, d10, f14 có đủ số electron tối đa gọi là phân lớp bão hòa. Phân lớp chưa đủ số electron tối đa gọi là chưa bão hòa. Phân lớp có 1 nửa số electron tối đa s1, p3, d5, f7 gọi là bán bão hòa.
b. Nguyên lí vững bền:
- Ở trạng thái cơ bản, trong nguyên tử các electron chiếm lần lượt những obitan có mức năng lượng từ thấp đến cao.
Ví dụ: Nguyên tử B có Z =5, có 5e sẽ phân bố lần lượt vào các obitan: 1s, 2s, 2p. Trong đó 2e vào AO-1s, 2e vào AO-2s và 1e vào AO-2p
Biểu diễn bằng ô lượng tử đối với nguyên tử B:
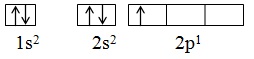
c. Quy tắc Hun:
- Trong cùng 1 phân lớp, các electron sẽ phân bố trên các obitan sao cho số electron độc thân là tối đa và các electron này phải có chiều tự quay giống nhau. Các e độc thân này được kí hiệu bằng các mũi tên cùng chiều, thường được viết hướng lên trên.
- Ví dụ: Nguyên tử N có Z = 7: có 7e, được phân bố vào các AO: 1s, 2s, 2p
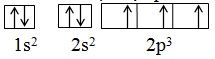
Tất cả nội dung bài viết. Các em hãy xem thêm và tải file chi tiết dưới đây:
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- Bài tập sự hình thành liên kết cộng hóa trị(06/11)
- Bài tập trắc nghiệm: Hạt nhân nguyên tử - Nguyên tố hóa học - Đồng vị(13/09)
- 35 bài tập haolen nâng cao (Có lời giải chi tiết)(23/06)
- BTTN tổng hợp phản ứng oxi hóa khử (Có lời giải chi tiết)(27/05)
- BTTN tổng hợp phản ứng oxi hóa khử(26/05)
- BTTN lý thuyết phản ứng oxi hóa khử(25/05)
- BTTN tính toán phản ứng oxi hóa khử(24/05)
- Một số dạng phản ứng oxi hóa khử cần nhớ(23/05)
- Bài tập kim loại tác dụng với hh axit có tính oxi hóa(21/05)
- PP bảo toàn electron trong giải BT KL tác dụng với axit có tính oxi hóa(20/05)
chuyên đề được quan tâm
bài viết mới nhất
- Đề thi chọn HSG môn Hóa học lớp 9 năm...
- Đề thi học sinh giỏi môn Hóa học năm 2020...
- Bài tập sự hình thành liên kết cộng hóa trị
- Phương pháp giải bài tập xác định công thức hóa...
- Tỉ khối của chất khí (Có ví dụ minh họa)
- Tổng hợp tính chất hóa học của các loại hợp...
- 26 bài tập axit - Bazo - Muối (Có đáp...
- 26 bài tập sự điện li (Có đáp án)
- Bài tập trắc nghiệm: Hạt nhân nguyên tử - Nguyên...
- Kiểm tra 45 phút chương IV
Cập nhật thông tin mới nhất của kỳ thi tốt nghiệp THPT 2025


