Thành phần nguyên tử
Cập nhật lúc: 11:08 02-07-2015 Mục tin: Hóa học lớp 10
Bài viết giúp các em biết nguyên tử được cấu tạo bởi những loại hạt cơ bản nào? Đặc tính của các loại hạt đó ra sao? Hạt nhân nguyên tử có gì đặc biệt?
Xem thêm:
Bài 1: Thành phần nguyên tử. Hạt nhân nguyên tử.
I. Kiến thức cơ bản:
1. Thành phần cấu tạo của nguyên tử:
- Từ các kết quả thực nghiệm, các nhà khoa học đã xác định được thành phần cấu tạo của nguyên tử gồm có hạt nhân và lớp vỏ electron. Trong đó:
+ Hạt nhân nằm ở tâm nguyên tử, gồm các hạt proton và nơtron
+ Vỏ nguyên tử gồm các electron chuyển động trong không gian xung quanh hạt nhân.
=> Nguyên tử được cấu tạo từ 3 loại hạt cơ bản là: electron, proton và nơtron.
- Khối lượng và điện tích của các loại hạt cấu tạo nên nguyên tử:
|
Đặc tính hạt |
Vỏ nguyên tử |
Hạt nhân |
|
|
Electron (e) |
Proton (p) |
Nơtron (n) |
|
|
Điện tích (q) |
qe = - 1,602.10-19 C (1- đơn vị điện tích nguyên tố) |
qp= +1,602.10-19 C (1+ đơn vị điện tích nguyên tố) |
qn= 0 |
|
Khối lượng (m) |
me = 9,1094.10-31 kg |
mp= 1,6726.10-27 kg |
mn= 1,6749.10-27 kg. |
- Nguyên tử trung hòa về điện nên số proton (P) trong hạt nhân bằng số electron (E) của nguyên tử. P = E
- Kích thước nguyên tử: các nguyên tử có kích thước khoảng 10-10 m= 0,1nm. Nguyên tử nhỏ nhất là nguyên tử hidro có bán kính khoảng 0,053nm.
- Kích thước hạt nhân: nhỏ hơn các hạt nhân đều có kích thước khoảng 10-14m = 10-5 nm.
- Kích thước của electron và proton: nhỏ hơn rất nhiều so với kích thước
- Đơn vị khối lượng nguyên tử: u
1u = khối lượng của một nguyên tử đồng vị 12C =1,67.10-27 kg = 1,67.10-24 g
- Đơn vị điện tích nguyên tố: 1đơn vị điện tích nguyên tố = 1,602.10-19 C
2. Hạt nhân nguyên tử. Nguyên tố hóa học:
a. Hạt nhân nguyên tử.
- Hạt nhân gồm các hạt proton và các hạt nơtron. Hạt nhân có Z proton thì có điện tích Z+ và số đơn vị điện tích hạt nhân bằng Z.
Số đơn vị điện tích hạt nhân = số proton = số electron. Z = P = E
- Số khối A của hạt nhân: là tổng số proton Z và số nơtron N. A = Z + N
- Khối lượng nguyên tử bằng tổng số khối lượng proton, notron và electron, vì khối lượng electron rất nhỏ nên có thể coi khối lượng nguyên tử bằng khối lượng hạt nhân.
b. Nguyên tố hóa học:
- Nguyên tố hóa học: là những nguyên tử có cùng điện tích hạt nhân.
- Tất cả các nguyên tử của cùng một nguyên tố hóa học đều có cùng số proton và cùng số electron. Những nguyên tử có cùng điện tích hạt nhân đều có tính chất hóa học giống nhau.
- Số hiệu nguyên tử Z của một nguyên tố là số đơn vị điện tích hạt nhân của nguyên tố đó.
- Số hiệu nguyên tử Z cho biết:
+ Số proton trong hạt nhân nguyên tử.
+ Số electrong trong nguyên tử
+ Nếu biết số khối A và số hiệu nguyên tử Z của nguyên tố, ta tính được số nơtron trong hạt nhân nguyên tử của nguyên tố đó. N = A – Z
- Kí hiệu nguyên tử: Số đơn vị điện tích hạt nhân và số khối được coi là những đặc trưng cơ bản của nguyên tử. Để kí hiệu nguyên tử, các chỉ số đặc trưng được ghi phía bên trái của kí hiệu nguyên tố.
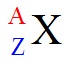
Với: X là kí hiệu nguyên tố
A: Số khối
Z: số hiệu nguyên tử
II. Bài tập áp dụng:
Câu 1: Nguyên tố được cấu tạo bởi mấy loại hạt cơ bản?
- 1 B. 2 C. 3 D.4
Câu 2: Trong nguyên tử, hạt mang điện là:
A. Electron B. Electron và notron
C. Proton và notron D. Electron và proton
Câu 3: Hạt mang điện trong hạt nhân nguyên tử ![]() là:
là:
A. Electron B.Proton C. Notron D. Cả A và B
Câu 4: Phát biểu nào sau đây không đúng:
- Nguyên tử được cấu tạo bởi các loại hạt cơ bản: proton, notron, electron.
- Thành phần cấu tạo của nguyên tử gồm hạt nhân và lớp vỏ electron.
- Điện tích hạt nhân bằng số proton và số electrong trong nguyên tử.
- Số khối A của nguyên tử được tính bằng tổng của số proton và số notron trong nguyên tử.
Câu 5: Cho các phát biểu sau:
(1) Nguyên tử được cấu tạo tử 3 loại hạt cơ bản.
(2) Hạt nhân nằm ở tâm nguyên tử, gồm các hạt proton và nơtron.
(3) Nguyên tử trung hòa về điện nên số proton bằng số notron.
(4) Vỏ nguyên tử gồm các electron chuyển động trong không gian xung quanh hạt nhân
(5) Số khối A của nguyên tử là tổng của số proton và số electron trong nguyên tử.
(6) Số đơn vị điện tích hạt nhân bằng số electron.
Số phát biểu đúng là:
A. 3 B. 4 C. 5 D.6
Câu 6: Nguyên tử flo có 9 proton, 9 electron và 10 notron. Số khối của nguyên tử flo là:
A. 10 B.18 C. 19 D. 28
Câu 7: Số notron trong nguyên tử là:
A.19 B. 20 C.39 D.58
Câu 8: Nguyên tử photpho có 16 notron, 15 proton. Số hiệu nguyên tử của P là:
A. 15 B. 16 C. 31 D. 30
Câu 9: Một ion có 3 proton, 4 notron và 2 electron. Điện tích của ion này là:
A. 3+ B. 2- C. 1+ D. 1-
Câu 10: Một ion có 13 proton, 14 notron, 10 electron. Ion này có điện tích là:
A. 3- B. 3+ C. 1- D. 1+
Đáp án:
1C 2D 3B 4C 5B 6C 7B 8A 9C 10B
Mọi góp ý và thắc mắc các em để lại ở phần Bình luận nhé :)
Chúc các em học vui với hoahoc247.com :)
Tất cả nội dung bài viết. Các em hãy xem thêm và tải file chi tiết dưới đây:
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- Bài tập sự hình thành liên kết cộng hóa trị(06/11)
- Bài tập trắc nghiệm: Hạt nhân nguyên tử - Nguyên tố hóa học - Đồng vị(13/09)
- 35 bài tập haolen nâng cao (Có lời giải chi tiết)(23/06)
- BTTN tổng hợp phản ứng oxi hóa khử (Có lời giải chi tiết)(27/05)
- BTTN tổng hợp phản ứng oxi hóa khử(26/05)
- BTTN lý thuyết phản ứng oxi hóa khử(25/05)
- BTTN tính toán phản ứng oxi hóa khử(24/05)
- Một số dạng phản ứng oxi hóa khử cần nhớ(23/05)
- Bài tập kim loại tác dụng với hh axit có tính oxi hóa(21/05)
- PP bảo toàn electron trong giải BT KL tác dụng với axit có tính oxi hóa(20/05)
chuyên đề được quan tâm
bài viết mới nhất
- Đề thi chọn HSG môn Hóa học lớp 9 năm...
- Đề thi học sinh giỏi môn Hóa học năm 2020...
- Bài tập sự hình thành liên kết cộng hóa trị
- Phương pháp giải bài tập xác định công thức hóa...
- Tỉ khối của chất khí (Có ví dụ minh họa)
- Tổng hợp tính chất hóa học của các loại hợp...
- 26 bài tập axit - Bazo - Muối (Có đáp...
- 26 bài tập sự điện li (Có đáp án)
- Bài tập trắc nghiệm: Hạt nhân nguyên tử - Nguyên...
- Kiểm tra 45 phút chương IV
Cập nhật thông tin mới nhất của kỳ thi tốt nghiệp THPT 2025


