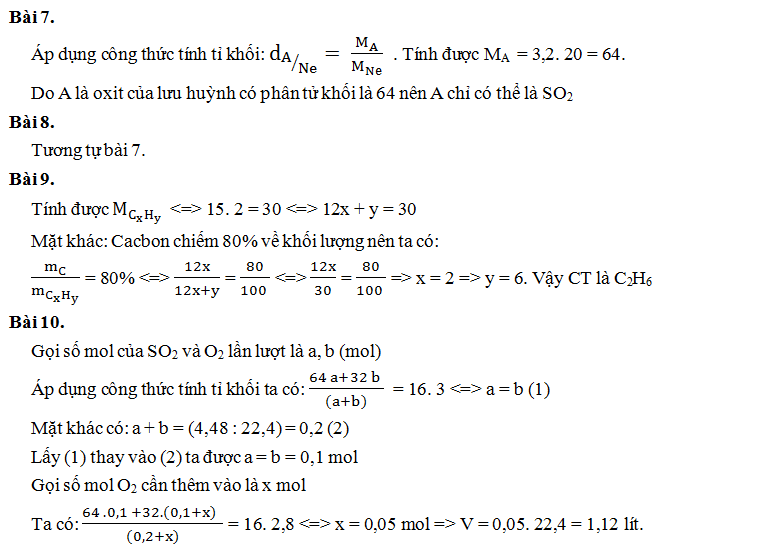BTTN về tỉ khối (Có lời giải chi tiết)
Cập nhật lúc: 17:50 18-05-2016 Mục tin: Hóa học lớp 8
Tỉ khối là một trong những kiến thức hóa học quan trọng.Bài viết này sẽ giúp các em hiểu sâu hơn về tỉ khối khí, cách giải bài tập về tỉ khối khí.
Xem thêm:
BÀI TẬP TRẮC NGHIỆM VỀ TỈ KHỐI KHÍ
Bài 1. Oxi có tỉ khối đối với không khí là:
A. 1,1
B. 1,2
C. 1,3
D. 1,4
Bài 2. Tỉ khối của hỗn hợp chứa 3,36 lít khí H2 và 6,72 lít khí N2 so với heli là:
A. 4,83
B. 18,33
C. 33,18
D. 33,19
Bài 3. Tỉ khối của hỗn hợp chứa 4 g metan và 7 g khí etilen so với không khí là:
A. 22/ 28
B. 22/ 29
C. 29/21
D. 29/22
Bài 4. Tỉ khối của hỗn hợp chứa N2 và O2 theo tỉ lệ vê thể tích là 1: 2 so với không khí là:
A. 92/87
B. 87/92
C. 82/97
D. 97/82
Bài 5. Tỉ khối của hỗn hợp chứa N2 và O3 theo tỉ lệ 1: 2 so với không khí là:
A. 128/47
B. 124/87
C. 127/48
D. 148/27
Bài 6. Ở đktc, 0,5 lít khí X có khối lượng là 1,25 (g)
a. Khối lượng mol phân tử của khí X là:
A. 24
B. 65
C. 56
D. 64
b. Tỉ khối hơi của X đối với không khí với CO2 và đối với CH4 lần lượt là:
A. 1,93; 1,27; 3,5
B. 1,92; 1,25; 3,7
C. 1,25; 3,6; 1,92
D. 3,5; 1,27; 1,93
Bài 7. A là oxit của lưu huỳnh có tỉ khối hơi so với Ne là 3,2. Vậy A có công thức phân tử là:
A. SO2
B. CO2
C. SO3
D. NO2
Bài 8. B là oxit của nitơ có tỷ khối hơi so với mêtan (CH4) là 1,875. B có công thức phân tử là:
A. NO2
B. N2O
C. N2O4
D.NO
Bài 9. A là hợp chất CxHy có tỷ khối hơi đối với H2 là 15 biết cacbon chiếm 80% khối lượng phân tử. Công thức phân tử của CxHy là:
A. CH4
B. C2H6
C. C3H8
D. C2H2
Bài 10. Hỗn hợp khí SO2 và O2 có tỉ khối so với CH4 là 3. Thể tích khí O2 cần thêm vào 4,48 lít hỗn hợp trên (đktc) để có tỉ khối so với CH4 giảm còn 2,8 là:
A. 2,24 lít
B. 1,12 lít
C. 11,2 lít
D. 22,4 lít
ĐÁP ÁN
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
A |
A |
B |
A |
B |
a. C b. A |
A |
D |
B |
B |
Tất cả nội dung bài viết. Các em hãy xem thêm và tải file chi tiết dưới đây:
>> Học trực tuyến lớp 8 trên Tuyensinh247.com. Đầy đủ khoá học các bộ sách: Kết nối tri thức với cuộc sống; Chân trời sáng tạo; Cánh diều. Cam kết giúp học sinh lớp 8 học tốt, hoàn trả học phí nếu học không hiệu quả. PH/HS tham khảo chi tiết khoá học tại: Link
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- Phương pháp giải bài tập xác định công thức hóa học(20/10)
- Tỉ khối của chất khí (Có ví dụ minh họa)(10/10)
- Đề kiểm tra 45 phút chương IV: Oxi - không khí (2 đề - có đáp án)(15/07)
- Đề kiểm tra 15 phút chương II: Phản ứng hóa học (3 đề - lời giải chi tiết)(22/06)
- Đề kiểm tra 15 phút chương III: Mol và tính toán hóa học (3 đề - có đáp án)(22/06)
- Đề kiểm tra 45 phút chương I: Chất, nguyên tử, phân tử (Có đáp án)(21/06)
- Đề kiểm tra 45 phút chương II: Phản ứng hóa học(21/06)
- Tính hóa trị của nguyên tố(27/05)
- Pha trộn 2 dd có xảy ra phản ứng(25/05)
- BTTN nồng độ dung dịch(25/05)
chuyên đề được quan tâm
bài viết mới nhất
- Đề thi chọn HSG môn Hóa học lớp 9 năm...
- Đề thi học sinh giỏi môn Hóa học năm 2020...
- Bài tập sự hình thành liên kết cộng hóa trị
- Phương pháp giải bài tập xác định công thức hóa...
- Tỉ khối của chất khí (Có ví dụ minh họa)
- Tổng hợp tính chất hóa học của các loại hợp...
- 26 bài tập axit - Bazo - Muối (Có đáp...
- 26 bài tập sự điện li (Có đáp án)
- Bài tập trắc nghiệm: Hạt nhân nguyên tử - Nguyên...
- Kiểm tra 45 phút chương IV
Cập nhật thông tin mới nhất của kỳ thi tốt nghiệp THPT 2025