Kim loại kiềm
Cập nhật lúc: 09:54 07-10-2015 Mục tin: Hóa học lớp 12
Bài viết đưa ra các lý thuyết trọng tâm về kim loại kiềm ngắn gọn, dễ hiểu.
KIM LOẠI KIỀM
I. Vị trí nguyên tố
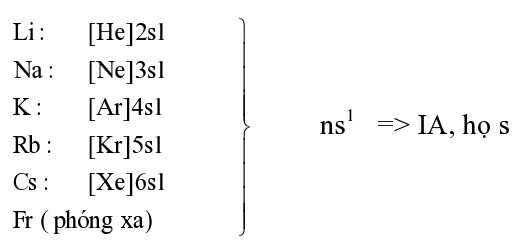
Mạng tinh thể lập phương tâm khối
II. Tính chất vật lí
- R lớn nhất trong 1 chu kì => Liên kết kim loại yếu
- Nhiệt độ nóng chảy, nhiệt độ sôi thấp Li Cs
- Độ cứng nhỏ
- D < 5 g/cm3
III. Tính chất hóa học
R mã , độ âm điện nhỏ, I1 thấp => tính khử mạnh
M → M+ + e (tăng dần Li Cs)
Thể hiện
1. Tác dụng với phi kim
2M + H2 → 2MH
Thí dụ:
4Na + O2 2Na2O
2Na + O2 → Na2O2
natripeoxit
6Li + N2 → 2LiN3
2. Tác dụng với nước (EoM+/M < 0)
Na + H2O → NaOH + ½ H2
M + H2O → M+ + OH- + ½ H2
3. Tác dụng với dd axit
Na + HCl → NaCl + ½ H2↑
Na dư + H2O → NaOH + ½ H2↑
4. Tác dụng với dd muối
Khi cho Na tác dụng với dd muối CuSO4 .
2 Na +2H2O →2NaOH +H2↑
2 NaOH+ CuSO4→Na2SO4 +Cu(OH)2$
IV. Ứng dụng
Kim lọai kiềm có nhiều ứng dụng quan trọng :
- Chế tạo hợp kim có nhiệt độ nóng chảy thấp dùng trong thiết bị báo cháy,…
- Các kim lọai Na và K dùng làm chất trao đổi nhiệt trong 1 vài lọai lò phản ứng hạt nhân.
- Kim lọai xesi dùng chế tạo tế bào quang điện.
- Điều chế 1 số kim lọai hiếm bằng phương pháp nhiệt luyện.
- Dùng nhiều trong tổng hợp hữu cơ.
V. Điều chế
- Trong tự nhiên kim lọai kiềm chỉ tồn tại ở dạng hợp chất.
- Phương pháp thường dùng để điều chế kim lọai kiềm là điện phân nóng chảy muối halogenua hoặc hiđroxit của kim loại kiềm trong điều kiện không có không khí.
Thí dụ :
*Na được điều chế bằng cách điện phân nóng chảy hỗn hợp NaCl với 25% NaF và 12% KCl ở nhiệt độ cao, cực dương than chì và cực âm làm bằng Fe.
2NaCl 2Na + Cl2
* Li được điều chế bằng cách điện phân hỗn hợp LiCl và KCl
* Rb và Cs được điều chế bằng cách dung kim loại Ca khử các clorua ở nhiệt độ cao và trong chân không:
2RbCl + Ca CaCl2 + 2Rb
CaC2 + 2CsCl 2C + CaCl2 + 2Cs
BÀI TẬP
Câu 1: Cấu hình electron lớp ngoài cùng của nguyên tử kim loại kiềm là
A. ns1. B. ns2.
C. ns2np1. D. (n–1)dxnsyy.
Câu 2: Cation M+ có cấu hình electron ở lớp ngoài cùng là 2s22p6. M+ là cation nào sau đây?
A. Ag+. B. Cu+. C. Na+. D. K+.
Câu 3: Nồng độ của dung dịch tạo thành khi hoà tan 39 gam kali kim loại vào 362 gam là kết quả nào sau đây?
A. 15,47%. B. 13,97%. C. 14%. D. 14,04%.
Câu 4: Những nguyên tố trong nhóm IA của bảng tuần hoàn được sắp xếp từ trên xuống dưới theo thứ tự tăng
dần của
A. điện tích hạt nhận nguyên tử. B. khối lượng riêng. C. nhiệt độ sôi. D. số oxi hoá.
Câu 5: Đặc điểm nào sau đây không là đặc điểm chung cho các kim loại nhóm IA?
A. số electron lớp ngoài cùng của nguyên tử.
B. số oxi hoá của các nguyên tố trong hợp chất. C. cấu tạo mạng tinh thể của các đơn chất.
D. bán kính nguyên tử.
Câu 6: Nguyên tố có năng lượng ion hoá nhỏ nhất là
A. Li. B. Na. C. K. D. Cs.
ĐÁP ÁN
|
1 |
2 |
3 |
4 |
5 |
6 |
|
A |
C |
C |
A |
D |
D |
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- Khái niệm, phân loại, danh pháp và tính chất vật lí của este(15/06)
- Tính chất hóa học của este (chi tiết)(10/06)
- Điều chế este và ứng dụng của este(15/06)
- Xác định công thức phân tử - công thức cấu tạo của este (Chi tiết - Có ví dụ minh họa)(17/06)
- Chuyên đề: Hiệu suất của phản ứng este hóa và phản ứng thủy phân este(17/06)
- Phản ứng đốt cháy este(21/06)
- Khái niệm, phân loại, trạng thái tự nhiên và tính chất vật lí của lipit(17/06)
- Tính chất hóa học của chất béo. Ứng dụng của chất béo.(17/06)
- Phản ứng xà phòng hóa chất béo (có video chữa)(17/06)
- Xà phòng. Chất giặt rửa.(22/06)
chuyên đề được quan tâm
bài viết mới nhất
- Đề thi chọn HSG môn Hóa học lớp 9 năm...
- Đề thi học sinh giỏi môn Hóa học năm 2020...
- Bài tập sự hình thành liên kết cộng hóa trị
- Phương pháp giải bài tập xác định công thức hóa...
- Tỉ khối của chất khí (Có ví dụ minh họa)
- Tổng hợp tính chất hóa học của các loại hợp...
- 26 bài tập axit - Bazo - Muối (Có đáp...
- 26 bài tập sự điện li (Có đáp án)
- Bài tập trắc nghiệm: Hạt nhân nguyên tử - Nguyên...
- Kiểm tra 45 phút chương IV
Cập nhật thông tin mới nhất của kỳ thi tốt nghiệp THPT 2025


