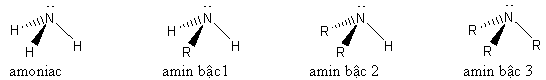Amin - Tính chất hóa học
Cập nhật lúc: 09:52 08-09-2015 Mục tin: Hóa học lớp 12
Các câu hỏi lí thuyết so sánh tính bazo của các amin là một trong những câu hỏi phổ biến trong các đề thi ĐH, CĐ cùng với đó là các bài tập tính toán về amin cũng rất quan trọng. Cùng nắm vững các tính chất hóa học của amin qua bài viết này.
Xem thêm:
III – CẤU TẠO PHÂN TỬ VÀ SO SÁNH LỰC BAZƠ
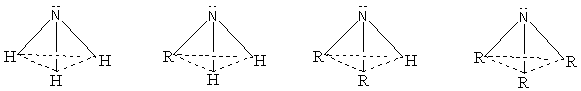
1. Cấu trúc phân tử của amoniac và các amin
2. Cấu tạo phân tử của amoniac và các amin
Trên nguyên tử nitơ đều có cặp electron tự do nên amoniac và các amin đều dễ dàng nhận proton. Vì vậy amoniac và các amin đều có tính bazơ.
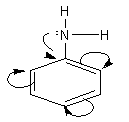
3. Đặc điểm cấu tạo của phân tử anilin
- Do gốc phenyl (C6H5–) hút cặp electron tự do của nitơ về phía mình, sự chuyển dịch electron theo hiệu ứng liên hợp p – p (chiều như mũi tên cong) làm cho mật độ electron trên nguyên tử nitơ giảm đi, khả năng nhận proton giảm đi. Kết quả là làm cho tính bazơ của anilin rất yếu (không làm xanh được quỳ tím, không làm hồng được phenolphtalein).
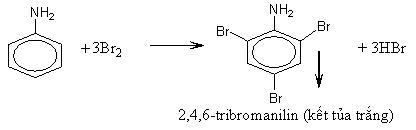
- Nhóm amino (NH2) làm tăng khả năng thế Br vào gốc phenyl (do ảnh hưởng của hiệu ứng +C). Phản ứng thế xảy ra ở các vị trí ortho và para do nhóm NH2 đẩy electron vào làm mật độ electron ở các vị trí này tăng lên
4. So sánh lực bazơ
a) Các yếu tố ảnh hưởng đến lực bazơ của amin:
- Mật độ electron trên nguyên tử N: mật độ càng cao, lực bazơ càng mạnh và ngược lại
- Hiệu ứng không gian: gốc R càng cồng kềnh và càng nhiều gốc R thì làm cho tính bazơ giảm đi, phụ thuộc vào gốc hiđrocacbon. Ví dụ tính bazơ của (CH3)2NH > CH3NH2 > (CH3)3N ; (C2H5)2NH > (C2H5)3N > C2H5NH2
b) Phương pháp
Gốc đẩy electron làm tăng tính bazơ, gốc hút electron làm giảm tính bazơ. Ví dụ: p-NO2-C6H4NH2 < C6H5NH2< NH3 < CH3NH2 < C2H5NH2 < C3H7NH2
- Amin có càng nhiều gốc đẩy e thì tính bazơ càng mạnh, amin có càng nhiều gốc hút e thì tính bazơ càng yếu.
(Rthơm)3N < (R thơm)2NH < RthơmNH2 < NH3 < Rno NH2 < (Rno)2NH < (Rno)3N
Chú ý rằng với gốc Rno càng cồng kềnh thì ảnh hưởng không gian của nó càng lớn làm cản trở quá trình H+ tiến lại gần nguyên tử N nên (Rno)2NH < (Rno)3N sẽ không còn đúng nữa.
IV – TÍNH CHẤT HÓA HỌC
1. Tính chất của chức amin
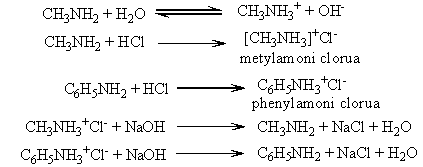
a) Tính bazơ: tác dụng lên giấy quỳ tím ẩm hoặc phenolphtalein và tác dụng với axit
- Dung dịch metylamin và nhiều đồng đẳng của nó có khả năng làm xanh giấy quỳ tím hoặc làm hồng phenolphtalein do kết hợp với proton mạnh hơn amoniac
- Anilin và các amin thơm rất ít tan trong nước. Dung dịch của chúng không làm đổi màu quỳ tím và phenolphtalein
b) Phản ứng với axit nitrơ:
- Amin no bậc 1 + HNO2 → ROH + N2 + H2O. Ví dụ: C2H5NH2 + HONO → C2H5OH + N2 + H2O
- Amin thơm bậc 1 tác dụng với HNO2 ở nhiệt độ thấp tạo thành muối điazoni.
Ví dụ: C6H5NH2 + HONO + HCl ![]() C6H5N2+ Cl- + 2H2O
C6H5N2+ Cl- + 2H2O
benzenđiazoni clorua
c) Phản ứng ankyl hóa: amin bậc 1 hoặc bậc 2 tác dụng với ankyl halogenua (CH3I, ….)
Phản ứng này dùng để điều chế amin bậc cao từ amin bậc thấp hơn.
Ví dụ: C2H5NH2 + CH3I → C2H5NHCH3 + HI
d) Phản ứng của amin tan trong nước với dung dịch muối của các kim loại có hiđroxit kết tủa
3CH3NH2 + FeCl3 + 3H2O → Fe(OH)3 + 3CH3NH3Cl
2. Phản ứng thế ở nhân thơm của anilin
BÀI TẬP ÁP DỤNG
Câu 1. Dãy gồm các chất đều làm quỳ tím ẩm chuyển sang màu xanh là
A. anilin, metyl amin, amoniac B.amoni clorua, metyl amin, natri hidroxit
C. anilin, aminiac, natri hidroxit D. metyl amin , amoniac, natri axetat.
Câu 2. Có 3 chất lỏng: benzen , anilin, stiren đựng riêng biệt trong 3 lọ mất nhãn . Thuốc thử để phân biệt 3 chất lỏng trên là :
A. dd phenolphtalein B.dd Br2
C.dd NaOH D. Quỳ tím
Câu 3. Cho các chất: etyl axetat, etanol , axit acrylic , phenol , anilin , phenyl amoni clorua, ancol benzylic, p – crezol. Trong các chất trên , số chất pứ với NaOH là :
A.3 B.4 C.5. D.6
Câu 4. NHận định nào sau đây ko đúng ?
A.các amin đều có khả năng nhận proton.
B.Tính bazo của các amin đều mạnh hơn NH3.
C.Metyl amin có tính bazo mạnh hơn anilin
D.CT TQ của amino , mạnh hở là : CnH2n+2+2Nk
Câu 5. dd metyl amin không tác dụng với chất nào sau đây?
A.dd HCl B.dd Br2/CCL4
C.dd FeCL3 D. HNO2
Câu 6. Để tách riêng hh khí CH4 và CH3NH2 ta dùng :
A.HCL B. HCl, NaOH
C. NaOH , HCL D.HNO2
Câu 7. Để phân biệt các dd : CH3NH2, C6H5OH , CH3COOH , CH3CHO không thể dùng
A.quỳ tím , dd Br2 B.Quỳ tím , AgNO3/NH3
C.dd Br2 , phenolphtalein D. Quỳ tím, Na kim loại
Câu 8. Cho anilin tác dụng với các chất sau: dd Br2 , H2 , CH3I , dd HCl , dd NaOH , HNO2. Số pứ xảy ra là :
A.3 B.4 C.5 D.6
Câu 9. Cho các chất sau: (1) NH3 ; (2) CH3NH2; (3) (CH3)2NH ; (4) C6H5NH2 ; (5) (C6H5)2NH . Thứ tự tăng dần tính bazo của các chất trên là :
A.(4) < (5) < (1) < (2) < (3) B.(1) < (4) < (5) < (2) < (3)
C.(5) < (4) < (1) < (2) < (3) D.(1) < (5) < (2) < (3) < (4)
Câu 10. Đốt cháy hoàn toàn 1 amin no đơn chức, bậc 2, mạch hở X thu được và hơi nước theo tỉ lệ số mol tương ứng là 2 : 3. Công thức cấu tạo của X là
A.CH3 – NH – CH3 B.CH3 – NH – C2H5
C.CH3 – CH2 – CH2 – NH2 D.C2H5 – NH – C2H5
ĐÁP ÁN
|
1 |
2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
|
D |
B |
C |
B |
B |
B |
D |
C |
C |
B |
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- Khái niệm, phân loại, danh pháp và tính chất vật lí của este(15/06)
- Tính chất hóa học của este (chi tiết)(10/06)
- Điều chế este và ứng dụng của este(15/06)
- Xác định công thức phân tử - công thức cấu tạo của este (Chi tiết - Có ví dụ minh họa)(17/06)
- Chuyên đề: Hiệu suất của phản ứng este hóa và phản ứng thủy phân este(17/06)
- Phản ứng đốt cháy este(21/06)
- Khái niệm, phân loại, trạng thái tự nhiên và tính chất vật lí của lipit(17/06)
- Tính chất hóa học của chất béo. Ứng dụng của chất béo.(17/06)
- Phản ứng xà phòng hóa chất béo (có video chữa)(17/06)
- Xà phòng. Chất giặt rửa.(22/06)
chuyên đề được quan tâm
bài viết mới nhất
- Đề thi chọn HSG môn Hóa học lớp 9 năm...
- Đề thi học sinh giỏi môn Hóa học năm 2020...
- Bài tập sự hình thành liên kết cộng hóa trị
- Phương pháp giải bài tập xác định công thức hóa...
- Tỉ khối của chất khí (Có ví dụ minh họa)
- Tổng hợp tính chất hóa học của các loại hợp...
- 26 bài tập axit - Bazo - Muối (Có đáp...
- 26 bài tập sự điện li (Có đáp án)
- Bài tập trắc nghiệm: Hạt nhân nguyên tử - Nguyên...
- Kiểm tra 45 phút chương IV
Cập nhật thông tin mới nhất của kỳ thi tốt nghiệp THPT 2025