Các dạng bài tập về amin
Cập nhật lúc: 09:49 09-09-2015 Mục tin: Hóa học lớp 12
Bài viết đưa ra các dạng bài tập về amin và phương pháp giải các dạng bài tập.
Các dạng bài tập về amin
Dạng 1: Số đồng phân của amin đơn chức
Với amin no, đơn chức mạch hở : CnH2n + 3N
Tổng số công thức cấu tạo 2 ( n -1 )
Tổng số công thức cấu tạo bậc 1 : 2( n – 2)
Tổng số công thức cấu tạo bậc 2 :
![]()
Ví dụ: Cho amin no đơn chức có %N = 23,72% . Tìm số đồng phân bậc 3 của amin đó
A. 1 B.2 C.3 D.4
PP: amin no đơn chức => CT: CnH2n+3N
=> %N = Giải ra được n = 3
=> CT : C3H7N2 => Có đồng phân bậc 3 là 1
Dạng 2: So sánh tính bazơ của các amin
(Rthơm)3N < (R thơm)2NH < RthơmNH2 < NH3 < Rno NH2 < (Rno)2NH < (Rno)3N
Chú ý rằng với gốc Rno càng cồng kềnh thì ảnh hưởng không gian của nó càng lớn làm cản trở quá trình H+ tiến lại gần nguyên tử N nên (Rno)2NH < (Rno)3N sẽ không còn đúng nữa.
Ví dụ 1: So sánh tính bazơ của các hợp chất hữu cơ sau: NH3 , C2H5NH2 , CH3NH2 , C6H5NH2 , (C6H5)2NH , (C2H5)2NH , C6H5 CH2NH2 ?
(C2H5)2NH > C2H5NH2 > CH3NH2 > NH3 > C6H5> CH2NH2 > C6H5NH2 > (C6H5)2NH
Ví dụ 2: Cho các chất: (1) amoniac. (2) metylamin. (3) anilin. (4) dimetylamin.
Tính bazơ tăng dần theo thứ tự nào sau đây?
A. (1) < (3) < (2) < (4). B. (3) < (1) < (2) < (4).
C. (1) < (2) < (3) < (4). D. (3) < (1) < (4) < (2).
Amoniac : NH3 ; metyamin : CH3NH2 ; anilin : C6H5NH2 ; dimetyl amin : CH3 – NH – CH3
Dựa vào tính chất trên : anilin có vòng benzen(gốc phenyl) => Tính bazo yếu nhất
NH3 ở mức trung gian > C6H5NH2
Amin bậc I (CH3NH2) < Amin bậc 2 (NH3 – NH –NH3)
=> Thư tự : C6H5NH2 < CH3 < CH3NH2<(CH3)2NH
Dạng 3: Xác định số nhóm chức :
Nếu đề bài cho số mol amin và số mol axit (H+) lập tỉ số : Số nhóm chức = \(\frac{nH+}{n amin}\)
Nếu amin chỉ có 1N => số chức = 1
Ví dụ: Để trung hòa 50 ml dd amin no , (trong amin có 2 nguyên tử Nito ) cần 40 ml dd HCl 0,1 M . CM của đimetyl amin đã dùng là :
A.0,08M B.0,04M C.0,02M D.0,06M
Amin có 2 N => amin có số chức = 2 ADCT : namin = nHCl/2 = 0,002 mol => CM amin = 0,04 M
Dạng 4 : Xác đinh công thức của amin dựa vào phản ứng cháy
![]()
nO2phản ứng = nCO2 + H2O
mamin = mC + mH + mN
Đốt amin no 2 chức ta có :
![]()
Lưu ý: Khi đốt cháy 1 amin ngoài không khí thì:
nN2 sau phản ứng = nN2 sinh ra từ phản ứng đốt cháy amin + nN2 có sẵn trong không khí
Ví dụ 1: Đốt cháy hoàn toàn amol hh X gồm 2 amin no đơn chức liêm tiếp nhau thu được 5,6 lít CO2 (đktc) và 7,2 g H2O . Giá trị của a là :
A. 0,05 mol B.0,1 mol C.0,15 mol D.0,2 mol
Tìm CT 2 amin đó ?
Lời giải
AD CT : namin = (nH2O – nCO2)/1,5
= (0,4 – 0,25)/1,5 = 0,1 mol
CT amin : n = => Amin có CT : CnH2n+1NH2
n = 2 và n = 3 :C2H5NH2 và C3H7NH2
Ví dụ 2 : Đốt cháy hoàn toàn V lit amin X bằng lượng O2 đủ tạo 8V lit hỗn hợp gồm khí CO2, N2 và hơi nước ( các thể tích khí đo trong cùng điều kiện. Amin X tác dụng HNO2 ở nhiệt độ thường tạo khí N2. X là
A. CH3-CH2-CH2-NH2 B. CH2=CH-CH2-NH2
C. CH3-CH2-NH-CH3 D. CH2=CH-NH-CH3
Lời giải
Do X tác dụng HNO2 ở nhiệt độ thường tạo N2, nên X là amin bậc 1 ( loại C, D)
Đặt X : CxHyN.
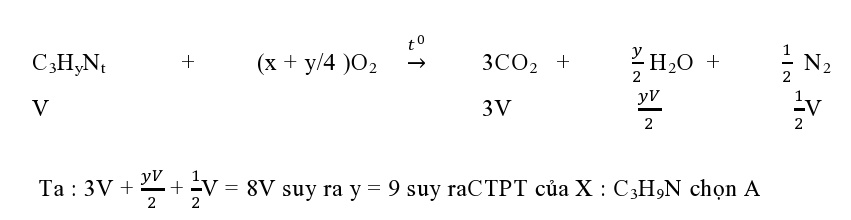
Ví dụ 3 : Đốt cháy hoàn toàn amin X thu 4,48 lit CO2 (đkc) và 6,3 gam nước. Tính thể tích không khí tối thiểu để đốt X ?
- 24 lit B. 34 lit C. 43 lit D. 42 lit
Lời giải
Ta có
![]()
Nên suy ra Vkhông khí = 5.22,4.0,375 = 42lit
Dạng 5: Cho amin tác dụng với dd muối của kim loại
Một số muối dễ tạo kết tủa hidroxit với dd amin
Ví dụ: AlCl3 + 3CH3NH2 + 3H2O Al(OH)3 + 3CH3NH3Cl
Lưu ý: Tương tự như NH3 các amin cũng tạo phức chất tan với Cu(OH)2, Zn(OH)2, AgCl…
Ví dụ: Khi sục khí CH3NH2 tới dư vào dd CuCl2 thì ban đầu xuất hiện kết tủa Cu(OH)2 màu xanh nhạt, sau đó kết tủa Cu(OH)2 tan trong CH3NH2 dư tạo thành dd phức [Cu(CH3NH2)4](OH)2màu xanh thẫm.
2CH3NH2 + CuCl2 + H2O Cu(OH)2 + 2CH3NH3Cl
Cu(OH)3 + 4CH3NH2 [Cu(CH3NH2)4](OH)2
Tất cả nội dung bài viết. Các em hãy xem thêm và tải file chi tiết dưới đây:
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- Khái niệm, phân loại, danh pháp và tính chất vật lí của este(15/06)
- Tính chất hóa học của este (chi tiết)(10/06)
- Điều chế este và ứng dụng của este(15/06)
- Xác định công thức phân tử - công thức cấu tạo của este (Chi tiết - Có ví dụ minh họa)(17/06)
- Chuyên đề: Hiệu suất của phản ứng este hóa và phản ứng thủy phân este(17/06)
- Phản ứng đốt cháy este(21/06)
- Khái niệm, phân loại, trạng thái tự nhiên và tính chất vật lí của lipit(17/06)
- Tính chất hóa học của chất béo. Ứng dụng của chất béo.(17/06)
- Phản ứng xà phòng hóa chất béo (có video chữa)(17/06)
- Xà phòng. Chất giặt rửa.(22/06)
chuyên đề được quan tâm
bài viết mới nhất
- Đề thi chọn HSG môn Hóa học lớp 9 năm...
- Đề thi học sinh giỏi môn Hóa học năm 2020...
- Bài tập sự hình thành liên kết cộng hóa trị
- Phương pháp giải bài tập xác định công thức hóa...
- Tỉ khối của chất khí (Có ví dụ minh họa)
- Tổng hợp tính chất hóa học của các loại hợp...
- 26 bài tập axit - Bazo - Muối (Có đáp...
- 26 bài tập sự điện li (Có đáp án)
- Bài tập trắc nghiệm: Hạt nhân nguyên tử - Nguyên...
- Kiểm tra 45 phút chương IV
Cập nhật thông tin mới nhất của kỳ thi tốt nghiệp THPT 2025


