Các dạng bài tập về Chất - Nguyên tử - NTHH
Cập nhật lúc: 11:50 13-05-2016 Mục tin: Hóa học lớp 8
Lý thuyết và bài tập luôn luôn song hành cùng nhau khi chúng ta học bất kì một môn nào. Môn hóa cũng vậy, việc học lý thuyết sau đó vận dụng vào làm bài tập luôn giúp các em hiểu rõ vấn đề. Bài viết sau đây sẽ giúp các em phân loại được các dạng bài tập phổ biến về chất - nguyên tử - nguyên tố hóa học sẽ giúp các em nắm chắc kiến thức từ đó sẽ giúp các em đạt điểm cao trong các bài kiểm tra.
Xem thêm:
CÁC DẠNG BÀI TẬP VỀ CHẤT - NGUYÊN TỬ - NGUYÊN TỐ HÓA HỌC
DẠNG 1. PHÂN BIỆT VẬT THỂ VÀ CHẤT
I. Hương giải:
- Vật thể: là hình dạng vật dụng tự nhiên và nhân tạo.
- Chất: là thành phần (nguyên liệu) cấu tạo nên vật thể.
II. Bài tập mẫu:
Bài 1. Phân biệt đâu là vật thể, đâu là chất trong các ý sau:
- Lốp, ruột xe làm bằng cao su.
- Bóng đèn điện được chế tạo từ thủy tinh, đồng, vonfram (vonfram là kim loại chịu nóng).
- Cây mía chứa nước, đường saccarozơ và bã (xenlulozơ ).
- Quả chanh chưa nước, axit citric…
Hướng dẫn giải:
|
|
Vật thể |
Chất |
|
a. |
lốp, ruột xe |
cao su |
|
b. |
bóng đèn điện |
thủy tinh, đồng, vonfram |
|
c. |
cây mía |
nước, đường saccarozơ , xenlulozơ |
|
d. |
quả chanh |
nước, axit citric |
Bài 2. Cho các chất sau:
- Gỗ (thành phần chính là xenlulozơ )
- Cao su
- Tinh bột
Các chất trên tồn tại ở vật thể tự nhiên, vật thể nhân tạo nào?
Hướng dẫn giải
|
|
Vật thể tự nhiên |
Vật thể nhân tạo |
|
a. Gỗ: |
thân cây mít, cây bạch đàn, cây phượng vĩ,…. |
Bàn, ghế, tủ gỗ, giường gỗ…. |
|
b. Cao su: |
nhựa cây sao su |
Lốp, ruột xe ô tô, xe máy, nệm cao su….. |
|
c. Tinh bột: |
hạt lúa, củ sắn….. |
Bánh dày, bánh đa, bánh quy… |
DẠNG 2. CẤU TẠO NGUYÊN TỬ
- Xác định số proton, số electron.
- Xác định số lớp electron.
- Xác định điện tích các loại hạt.
I. Hướng giải:
Trong một nguyên tử:
- Số protron = số electron. (trừ nguyên tử Hiđro)
- Tổng số electron ở các lớp trong một nguyên tử bằng tổng số electron của nguyên tử.
- Số electron lớp ngoài cùng thường trùng với hóa trị nguyên tố.
- Mỗi vòng là một lớp electron (trừ vòng trong cùng biểu thị hạt nhân nguyên tử.)
II. Bài tập mẫu
Bài 1. Cho các sơ đồ nguyên tử sau:
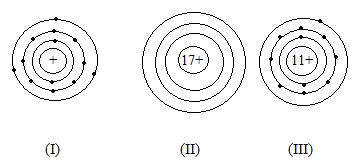
-
Dựa vào sơ đồ nguyên tử (I) cho biết:
- Số electron và proton trong hạt nhân nguyên tử
- Số lớp electron của nguyên tử
-
Dựa vào sơ đồ nguyên tử (II) cho biết:
- Số lớp electron và đisaccaritện tích của electron
- Lớp ngoài cùng có bao nhiêu electron.
-
Từ sơ đồ nguyên tử (III) cho biết:
- Số pronton, electron trong nguyên tử.
- Cho biết tên, kí hiệu hóa học và nguyên tử khối của nguyên tố ở sơ đồ (III).
Hướng dẫn giải:
1. a. Số proton (p): 11; số electron (e): 11.
b. Trong nguyên tử có 3 lớp e
2. a. Số e của nguyên tử là 17. Số điện tích của e là 17 -
b. Lớp ngoài cùng có 7 e.
3. a. số e là 11 và số p là 11
b. Vì số p = 11 nên nguyên tố là: natri, kí hiệu: Na, nguyên tử khối là 23đvC.
DẠNG 3. NGUYÊN TỐ HÓA HỌC
I. Hướng giải
- Tập hợp các nguyên tử có cùng số proton (p) thì thuộc cùng một nguyên tố hóa học.
- Nguyên tử khối là khối lượng của nguyên tử tính bằng đơn vị cacbon. 1đvC = 1.6605. 10-24 kg.
- Khối lượng nguyên tử = mp + mn + me = mp + mn (vì me rất bé)
- Cần nắm chắc kí hiệu hóa học (KHHH) của một số nguyên tố.
- So sánh khối lượng nguyên tử A với khối lượng nguyên tử B:
Đặt T = MA : MB . Nếu:
+ T = 1 → MA = MB
+ T > 1 → MA > MB
+ T < 1 → MA < MB
- MA : MB = a → MA = a.MB
II. Bài tập mẫu
Bài 1. Giả sử có kí hiệu sau: aA , trong đó:
Thì những nguyên tử nào sau đây thuộc cùng một nguyên tố hóa học
aA; bC; aD; cE; aF; dG
Hướng dẫn giải:
Những nguyên tố thuộc cùng một nguyên tố hóa học là: A, D, F.
Bài 2. Tính khối lượng gam của một nguyên tử magie.
Hướng dẫn giải:
1 đvC có khối lượng gam là 1,6605. 10-24g
24 đvC………………………x (g)
→ x (g) = (24. 1,6605. 10-24): 1 = 3,9854. 10-23g
Bài 3. Nguyên tử A nặng gấp hai nguyên tử oxi. Tính nguyên tử khối A. Viết KHHH của nguyên tố đó.
Hướng dẫn giải:
MA : MO= 2 → MA = 16. 2 = 32 đvC
Nguyên tử khối của A = 32 → A là lưu huỳnh: S
Tất cả nội dung bài viết. Các em hãy xem thêm và tải file chi tiết dưới đây:
>> Học trực tuyến lớp 8 trên Tuyensinh247.com. Đầy đủ khoá học các bộ sách: Kết nối tri thức với cuộc sống; Chân trời sáng tạo; Cánh diều. Cam kết giúp học sinh lớp 8 học tốt, hoàn trả học phí nếu học không hiệu quả. PH/HS tham khảo chi tiết khoá học tại: Link
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- Phương pháp giải bài tập xác định công thức hóa học(20/10)
- Tỉ khối của chất khí (Có ví dụ minh họa)(10/10)
- Đề kiểm tra 45 phút chương IV: Oxi - không khí (2 đề - có đáp án)(15/07)
- Đề kiểm tra 15 phút chương II: Phản ứng hóa học (3 đề - lời giải chi tiết)(22/06)
- Đề kiểm tra 15 phút chương III: Mol và tính toán hóa học (3 đề - có đáp án)(22/06)
- Đề kiểm tra 45 phút chương I: Chất, nguyên tử, phân tử (Có đáp án)(21/06)
- Đề kiểm tra 45 phút chương II: Phản ứng hóa học(21/06)
- Tính hóa trị của nguyên tố(27/05)
- Pha trộn 2 dd có xảy ra phản ứng(25/05)
- BTTN nồng độ dung dịch(25/05)
chuyên đề được quan tâm
bài viết mới nhất
- Đề thi chọn HSG môn Hóa học lớp 9 năm...
- Đề thi học sinh giỏi môn Hóa học năm 2020...
- Bài tập sự hình thành liên kết cộng hóa trị
- Phương pháp giải bài tập xác định công thức hóa...
- Tỉ khối của chất khí (Có ví dụ minh họa)
- Tổng hợp tính chất hóa học của các loại hợp...
- 26 bài tập axit - Bazo - Muối (Có đáp...
- 26 bài tập sự điện li (Có đáp án)
- Bài tập trắc nghiệm: Hạt nhân nguyên tử - Nguyên...
- Kiểm tra 45 phút chương IV
Cập nhật thông tin mới nhất của kỳ thi tốt nghiệp THPT 2025


