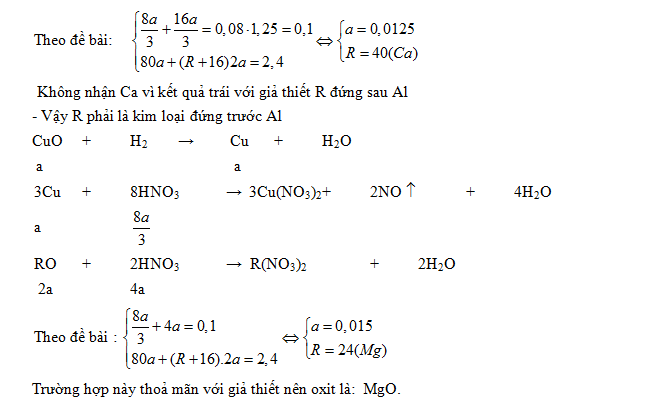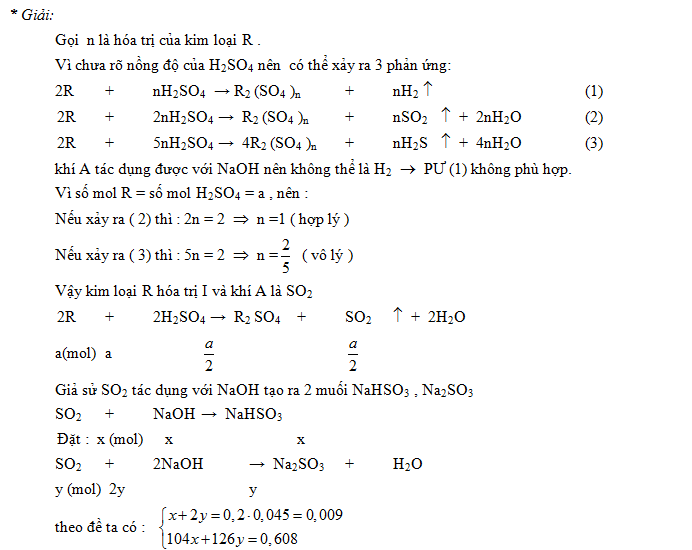Dạng toán biện luận về kim loại
Cập nhật lúc: 14:20 01-06-2016 Mục tin: Hóa học lớp 9
Dạng toán biện luận về kim loại là một dạng toán khó, đòi hỏi học sinh có kiến thức chắc chắn, tư duy linh hoạt.
Xem thêm:
CÁC DẠNG TOÁN BIỆN LUẬN VỀ KIM LOẠI
A. PHƯƠNG PHÁP GIẢI
Nguyên tắc áp dụng:
- Phương pháp này được áp dụng trong các bài toán xác định tên nguyên tố mà các dữ kiện đề cho thiếu hoặc các số liệu về lượng chất đề cho đã vượt quá, hoặc chưa đạt đến một con số nào đó.
- Cần sử dụng những tính chất đặc trưng của kim loại để tìm ra chìa khóa để giải toán. Để giải được bài toán biện luận cần nắm được:
+ Nguyên tử khối của kim loại luôn là số nguyên dương
+ Hóa trị của kim loại thường là: 1, 2, 3
+ Tinh thể ngậm nước luôn chứa số phân tử nước là số nguyên dương
VD: CuSO4. 5H2O hoặc H2SO4. 3 H2O
+ Dãy hoạt động hóa học của kim loại, ý nghĩa của dãy hoạt động hóa học
* Cần lưu ý một số điểm hỗ trợ việc tìm giới hạn thường gặp:
+) Hỗn hợp 2 chất A, B có số mol là a( mol) thì : 0 < nA, nB < a
+) Trong các oxit : R2Om thì : 1 £ m, nguyên £ 7
+) Trong các hợp chất khí của phi kim với Hiđro RHn thì : 1 £ n, nguyên £ 4
DẠNG 1: BIỆN LUẬN THEO ẨN SỐ TRONG GIẢI PHƯƠNG TRÌNH
Ví dụ 1: Hòa tan một kim loại chưa biết hóa trị trong 500ml dd HCl thì thấy thoát ra 11,2 dm3 H2 (đktc). Phải trung hòa axit dư bằng 100ml dd Ca(OH)2 1M. Sau đó cô cạn dung dịch thu được thì thấy còn lại 55,6 gam muối khan. Tìm nồng độ M của dung dịch axit đã dùng; xác định tên của kim loại đã đã dùng.
Cặp ẩn cần biện luận là nguyên tử khối R và hóa trị x
55,6 gam là khối lượng của hỗn hợp 2 muối RClx và CaCl2
* Giải :
Giả sử kim loại là R có hóa trị là x => x >= 1, nguyên, x<3
số mol Ca(OH)2 = 0,1´ 1 = 0,1 mol
số mol H2 = 11,2 : 22,4 = 0,5 mol
Các PTPƯ:
2R + 2xHCl → 2RClx + xH2 (1)
1/x (mol) 1 1/x 0,5
Ca(OH)2 + 2HCl → CaCl2 + 2H2O (2)
0,1 0,2 0,1
từ các phương trình phản ứng (1) và (2) suy ra:
nHCl = 1 + 0,2 = 1,2 mol
nồng độ M của dung dịch HCl : CM = 1,2 : 0,5 = 2,4 M
theo các PTPƯ ta có :
Ví dụ 2: Khi cho a (mol ) một kim loại R tan vừa hết trong dung dịch chứa a (mol ) H2SO4 thì thu được 1,56 gam muối và một khí A. Hấp thụ hoàn toàn khí A vào trong 45ml dd NaOH 0,2M thì thấy tạo thành 0,608 gam muối. Hãy xác định kim loại đã dùng.
GV: Cho HS biết H2SO4 chưa rõ nồng độ và nhiệt độ nên khí A không rõ là khí nào.Kim loại không rõ hóa trị; muối tạo thành sau phản ứng với NaOH chưa rõ là muối gì. Vì vậy cần phải biện luận theo từng trường hợp đối với khí A và muối Natri.
HS: Nêu các trường hợp xảy ra cho khí A : SO2 ; H2S ( không thể là H2 vì khí A tác dụng được với NaOH ) và viết các PTPƯ dạng tổng quát, chọn phản ứng đúng để số mol axit bằng số mol kim loại.
GV: Lưu ý với HS khi biện luận xác định muối tạo thành là muối trung hòa hay muối axit mà không biết tỉ số mol cặp chất tham gia ta có thể giả sử phản ứng tạo ra 2 muối. Nếu muối nào không tạo thành thì có ẩn số bằng 0 hoặc một giá trị vôlý.
Tất cả nội dung bài viết. Các em hãy xem thêm và tải file chi tiết dưới đây:
>> Học trực tuyến lớp 9 và Lộ trình UP10 trên Tuyensinh247.com Đầy đủ khoá học các bộ sách: Kết nối tri thức với cuộc sống; Chân trời sáng tạo; Cánh diều. Lộ trình học tập 3 giai đoạn: Học nền tảng lớp 9, Ôn thi vào lớp 10, Luyện Đề. Bứt phá điểm lớp 9, thi vào lớp 10 kết quả cao. Hoàn trả học phí nếu học không hiệu quả. PH/HS tham khảo chi tiết khoá học tại: Link
 |
 |
 |
 |
 |
 |
Các bài khác cùng chuyên mục
- Đề thi chọn HSG môn Hóa học lớp 9 năm 2020 THCS Võ Thị Sáu (01/10)
- Đề thi học sinh giỏi môn Hóa học năm 2020 Thị Xã Nghi Sơn (01/10)
- Tổng hợp tính chất hóa học của các loại hợp chất vô cơ(06/10)
- Kiểm tra 45 phút chương IV(30/08)
- Kiểm tra học kì I(30/08)
- Kiểm tra 15 phút chương V (30/08)
- Kiểm tra 15 phút chương IV (2 đề)(30/08)
- Đề kiểm tra 15 phút chương III (3 đề)(22/07)
- Đề kiểm tra 1 tiết chương III (2 đề)(22/07)
- Đề kiểm tra 45 phút chương II (2 đề)(21/07)
chuyên đề được quan tâm
bài viết mới nhất
- Đề thi chọn HSG môn Hóa học lớp 9 năm...
- Đề thi học sinh giỏi môn Hóa học năm 2020...
- Bài tập sự hình thành liên kết cộng hóa trị
- Phương pháp giải bài tập xác định công thức hóa...
- Tỉ khối của chất khí (Có ví dụ minh họa)
- Tổng hợp tính chất hóa học của các loại hợp...
- 26 bài tập axit - Bazo - Muối (Có đáp...
- 26 bài tập sự điện li (Có đáp án)
- Bài tập trắc nghiệm: Hạt nhân nguyên tử - Nguyên...
- Kiểm tra 45 phút chương IV
Cập nhật thông tin mới nhất của kỳ thi tốt nghiệp THPT 2025